Η Ιντερλευκίνη-17 (IL-17) είναι μια κυτταροκίνη με ανοσορρυθμιστικές ιδιότητες. Πρόκειται για μία προφλεγμονώδη κυτταροκίνη που εκκρίνεται από ενεργοποιημένα Τ-κύτταρα και ειδικότερα από τα βοηθητικά Τ λεμφοκύτταρα, γνωστά ως ΤH17 CD4 + Τ κύτταρα. Άλλες πηγές παραγωγής της ΙL-17 θεωρούνται τα ουδετερόφιλα, τα σιτευτικά κύτταρα (μαστοκύτταρα) και τα κυτταροτοξικά Τ κύτταρα (Tc17). [1].
Πολλές μελέτες έχουν αναδείξει το παθογενετικό ρόλο των Th17 κυττάρων και της IL-17Α στην ανάπτυξη φλεγμονωδών και αυτοάνοσων νοσημάτων, συμπεριλαμβανομένων της Ρευματοειδούς Αρθρίτιδας, της Ψωρίασης, της Ψωριασικής Αρθρίτιδας και του Συστηματικού Ερυθηματώδους Λύκου[2] κ.ά.
Ωστόσο η παρούσα αναφορά στοχεύει να εστιάσει στην βιοχημική ανάλυση της IL-17 επιδιώκοντας να περιγράψει συνοπτικά τους μηχανισμούς σηματοδότησης των υποδοχέων της. Αυτή η προσέγγιση δύναται να προσφέρει τη μοριακή βάση για την ανάπτυξη αποτελεσματικών θεραπευτικών στρατηγικών έναντι των παραπάνω ασθενειών.
Δομή και Λειτουργία της IL-17
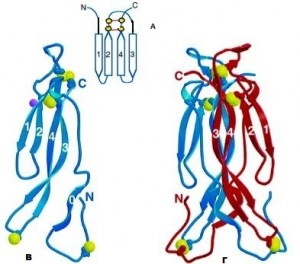
Η IL-17 είναι ένα ομοδιμερές μόριο γλυκοπρωτείνης 155 αμινοξέων με μοριακό βάρος 35 kDa. Αποτελείται από δύο μονομερή που συνδέονται με ενδομοριακούς δισουλφιδικούς δεσμούς σε κατάλοιπα κυστεΐνης. (Εικόνα 1).
Στη τρέχουσα βιβλιογραφία, η IL-17 αναφέρεται επίσημα ως IL-17Α, αλλά γενικά ονομάζεται IL-17. Η IL-17Α αποτελεί το πρώτο μέλος της οικογένειας της IL-17. Η οικογένειας της IL-17 αποτελείται από έξι μέλη –από την IL-17Α έως την IL-17F- , τα οποία περιέχουν καρβοξυ-τερματικά κατάλοιπα κυστεΐνης [3]. (Εικόνα 1)
Εικόνα 1:
Α. Aναπαράσταση σχεδίου της πτύχωσης κυστεΐνών. Οι β-αλυσίδες επισημαίνονται με τους αριθμούς 1-4, ενώ τα κατάλοιπα κυστεΐνης (παρόντα στις πρωτεΐνες IL-17), αντιπροσωπεύονται με κίτρινες σφαίρες, σχηματίζοντας μεταξύ τους ενδομοριακούς δισουλφιδικούς δεσμούς
Β. Κορδέλα μονομερούς μορίου IL-17F. Οι αλυσίδες β-πτυχωτού φύλλου επισημαίνονται με αριθμούς. Οι δισουλφιδικοί δεσμοί εκπροσωπούνται με σχηματισμούς μπαλών και ραβδίων (ball and stick representation), ενώ τα άτομα θείου απεικονίζονται με κίτρινες μπάλες
Γ. Κορδέλα διμερούς μορίου IL-17F. Οι δισουλφιδικοί δεσμοί απεικονίζονται όπως στη (Β)
Σημ.: Οι β-αλυσίδες (β-strands) είναι τα τμήματα της αμινοξικής ακολουθίας που συνδέονται μέσω υδρογονικών δεσμών –συνήθως αντιπαράλληλες- και διευθετούνται έτσι ώστε να σχηματίσουν δύο πτυχωτές επιφάνειες οι οποίες πακετάρονται η μία απέναντι στην άλλη ορίζοντας το δεύτερο κύριο στοιχείο δευτεροταγούς δομής στις πρωτεΐνες
Προσαρμογή: Sarah G. Hymowitz et al. IL-17s adopt a cystine knot fold: structure and activity of a novel cytokine, IL-17F, and implications for receptor binding (2001)
Τα κύρια μέλη της οικογένειας IL-17 είναι η IL-17Α και η IL-17F, που παράγονται κυρίως από τα κύτταρα TH17. Η IL-17 ανακαλύφθηκε το 1993 ως μία προφλεγμονώδης κυτταροκίνη, παραγόμενη από τα Τ βοηθητικά κύτταρα [4-6]. Η IL-17F ήταν το πρώτο μέλος της οικογένειας IL-17 στην οποία εφαρμόστηκε η βιοχημική τεχνική της κρυστάλλωσης. Μέσω αυτής της βιοχημικής τεχνικής, αποδείχτηκε ότι το ομοδιμερές αυτού του μορίου, σχηματίζει πτυχωτά μοτίβα κυστίνης[1], παρόμοια με εκείνα που σχηματίζονται από την οικογένεια υποδοχέων του αυξητικού παράγοντα νεύρων (nerve growth factor, NGF) [7].
Η IL-17F παρουσιάζει 50% ταυτοποίηση αλληλουχίας με την IL-17Α. Τα ομοδιμερή IL-17F συχνά συνεκφράζονται με την IL-17Α. Η IL-17F μπορεί επίσης να εκφρασθεί με την IL-17Α, ως το ετεροδιμερές IL-17Α-IL-17F [8] (Εικόνα. 2).
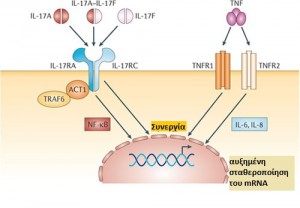
Εικόνα 2: Δομή της IL-17 και η αλληλεπίδρασή της με τον υποδοχέα IL-17R.
Τα μονομερή IL-17Α και IL-17F μπορούν να σχηματίσουν ομοδιμερή και το ετεροδιμερές IL-17Α-IL-17F. Αυτοί οι διμερείς συνδέτες δεσμεύονται στο σύμπλοκο υποδοχέα της IL-17 (IL-17R), το οποίο αποτελείται από τις αλυσίδες IL-17RA και IL-17RC. Η σηματοδότηση υποδοχέα επάγει την ενεργοποίηση της πρωτεΐνης προσαρμογέας (adaptor protein) ACT1, του πυρηνικού παράγοντα-κΒ (NF-κΒ) και του παράγοντα νέκρωσης όγκων (TNF) σχετιζόμενου με τον υποδοχέα του παράγοντα 6 (TRAF6), οδηγώντας σε αυξημένη μεταγραφή των γονιδίων που κωδικοποιούν την IL-6 και την IL-8. Ο TNF είναι ένα ομοτριμερές που αλληλεπιδρά με τον ΤΝF υποδοχέα 1 (TNFR1) και τον ΤΝF υποδοχέα 2 TNFR2. Ο συνδυασμός των προσδεμάτων IL-17 και ΤΝF οδηγεί συχνά σε συνεργικές δράσεις που μπορούν να εξηγηθούν εν μέρει από την αυξημένη σταθερότητα του mRNA και την υπερέκφραση του TNFR.
Προσαρμογή: Pierre Miossec & Jay K. Kolls Targeting IL-17 and TH17 cells in chronic inflammation. (2012)
Η IL-17F ως μεμονωμένο μακρομόριο είναι συνήθως λιγότερο ενεργή στην επαγωγή φλεγμονής σε σύγκριση με την IL-17Α. Όμως, τα αποτελέσματά της επαυξάνονται όταν συνδυάζεται με τον παράγοντα νέκρωσης όγκων (tumor necrosis factor, TNF) [9].
Ωστόσο, τα αποτελέσματα από πειραματικά μοντέλα φλεγμονής σε ποντίκια υποδεικνύουν ότι ορισμένες από τις προ-φλεγμονώδεις λειτουργίες της IL-17F και της IL-17Α δεν είναι ταυτόσημες [10]. Για παράδειγμα, σε ένα μοντέλο άσθματος επαγόμενο από τα κύτταρα Τh2, η γενετική διαγραφή (απαλοιφή) της IL-17F σε ποντικούς καταλήγει σε μία πιο ουσιαστική μείωση στην ουδετεροφιλική φλεγμονή του πνεύμονα συγκρινόμενη με την διαγραφή της IL-17A [10]. Επιπλέον, η γενετική διαγραφή της IL-17F μειώνει την πειραματική κολίτιδα, ενώ η διαγραφή της IL-17A αυξάνει τη σοβαρότητα της νόσου [10]. Ωστόσο, σε αρθρικά κύτταρα, δεν έχει ακόμη προσδιοριστεί κάποιο γονίδιο, ειδικά επαγόμενο από την IL-17F και όχι από την IL-17A [9].
Οι παραπάνω παρατηρήσεις αμφισβητούν τη χρησιμότητα της στόχευσης ειδικά της IL-17F ή σε συνδυασμό με την IL-17A. Σαφώς, χρειάζεται περισσότερη μελέτη σε ανθρώπους καθώς και σε πειραματικά μοντέλα της φλεγμονής, για να κατανοηθούν καλύτερα οι διαφορετικές αποκρίσεις στην IL-17A και στην IL-17F.
Η έρευνα σχετικά με τα υπόλοιπα μέλη της οικογένειας IL-17 είναι ακόμα στα σπάργανα, αλλά πρόσφατα αποδείχτηκε ότι η IL-17C μπορεί να ενισχύσει την παραγωγή της IL-17 από τα κύτταρα Th17 [11]. Παραμένει να προσδιοριστεί αν η IL-17C παριστά ένα επιπλέον θεραπευτικό στόχο στην οδό IL-17. Σε αντίθεση με τα άλλα μέλη, η IL-17E (επίσης γνωστή ως IL-25) επάγει αλλεργικές αποκρίσεις, την ενεργοποίηση της οδού Τh2 [12], αναστέλλει τη λειτουργία των κυττάρων Th17, επιφέροντας αντι-φλεγμονώδη αποτελέσματα σε φλεγμονώδη μοντέλα, όπου μεσολαβούν τα κύτταρα Th17 [13].
Υποδοχείς της IL-17
Δομή
Ο πρώτος υποδοχέας που αναγνωρίστηκε για την IL‑17 αναφέρθηκε αρχικά ως υποδοχέας IL‑17 (IL‑17R). Μετά τον εντοπισμό επιπλέον συστατικών που απαιτούνται για να σχηματιστεί ένα λειτουργικό σύμπλοκο του υποδοχέα για τη σηματοδότηση της IL‑17 [14], είναι γνωστός ως IL‑17RA [15]. Εκτός από τον υποδοχέα IL‑17RA, απαιτείται και ο υποδοχέας IL‑17RC για την κυτταρική σηματοδότηση σε απόκριση τόσο της IL‑17A όσο και της IL‑17F [16,17] (Εικόνα. 2).
Με βάση την αλληλουχία ομολογίας προς τον IL‑17RA, έχουν προσδιοριστεί τέσσερις πρόσθετοι υποδοχείς στην οικογένεια IL‑17R: ο IL‑17RB, ο IL‑17RC, ο IL‑17RD και ο IL‑17RE. Εκτός από τον IL‑17RC, έχει προταθεί ότι ο IL‑17RA μπορεί να σχηματίσει ένα σύμπλοκο με τον IL‑17RD και ότι ο IL‑17RD μπορεί να μεσολαβήσει στην μεταγενέστερη (καθοδική) σηματοδότηση της IL‑17 [30]. Επιπλέον, ο IL‑17RA μπορεί να σχηματίσει ένα σύμπλοκο με τον IL‑17RB και απαιτούνται αμφότερες οι αλυσίδες του υποδοχέα για την IL‑17E‑μεσολαβούμενη σηματοδότηση. Πρόσφατα αποδείχτηκε ότι η IL‑17C σηματοδοτείται μέσω ενός σύμπλοκου υποδοχέα, αποτελούμενο από τον IL‑17RA και τον IL‑17RE [11, 18, 19]. Έτσι, ο IL‑17RA φαίνεται να αποτελεί την κοινή υπομονάδα υποδοχέα για την οικογένεια συνδετών IL‑17. Η στόχευση του IL‑17RA μπορεί να οδηγήσει σε μια ευρύτερη αντιφλεγμονώδη απάντηση σε σύγκριση με την στόχευση συγκεκριμένων συνδετών IL‑17. Παράλληλα, η στόχευση του IL‑17RC παρουσιάζει το μειονέκτημα της εν δυνάμει εμφάνισης υψηλότερου κινδύνου παρενεργειών, όπως οι λοιμώξεις.
Σηματοδότηση
Ο IL‑17RA είναι ιδιαίτερος ανάμεσα στους υποδοχείς της ιντερλευκίνης 17 [15] εφόσον η σηματοδότηση δεν εκτελείται μέσω του μονοπατιού που εμπλέκει την κινάση JAK, το μεταγωγικό σήμα και τον ενεργοποιητή της μεταγραφής (STAT). Ειδικότερα, ο IL‑17RA συνδέεται με την πρωτεΐνη-προσαρμογέας, ACT1 (επίσης γνωστή ως TRAF3IP2) [20, 21] μέσω ενός συντηρημένου μοτίβου, που ονομάζεται περιοχή SEFIR, εκ του SEF (επίσης γνωστό και ως IL‑17RD) και της ομόλογης περιοχής TIR (Toll/IL‑1R). Η σύνδεση της IL‑17A στον υποδοχέα της, ενεργοποιεί τον πυρηνικό παράγοντα-κB (NF-κB) και η ενεργοποίηση αυτή απαιτεί την παρουσία τόσο της ACT1 όσο και του υποδοχέα TNF – συσχετιζόμενου παράγοντα 6 (TRAF6) [22] (Εικόνα 2).
Η διέγερση των επιθηλιακών κυττάρων ή των ινοβλαστών με την IL‑17A αυξάνει την έκφραση (τόσο σε επίπεδο mRNA όσο και πρωτεϊνών) των αυξητικών παραγόντων, όπως είναι ο παράγοντας διέγερσης αποικιών των κοκκιοκυττάρων (Granulocyte Colony Stimulating Factor/GCSF) και οι συνδέτες χημειοκίνης για τον CXCR2, συμπεριλαμβανομένου του συνδέτη 1 χημειοκίνης CXC μοτίβου (CXCL1), του CXCL2 και του CXCL8. Μία σημαντική επίδραση της IL‑17 στην υποομάδα των γονιδίων που κωδικοποιούν αυτές τις πρωτεΐνες είναι η αύξηση της σταθερότητας του mRNA. Η αύξηση στη σταθερότητα μεταγραφής έχει αποδειχθεί τόσο για τον G-CSF όσο και για τον CXCL1 [23, 24]. Εκτός από την ενεργοποίηση της οδού NF-κB, η IL‑17A μπορεί να ενεργοποιήσει την C/EBPβ και την C / EBPδ, που ανήκουν στην ευρεία οικογένεια CCAAT/ενισχυτής – πρωτεΐνες δέσμευσης (C/EBPs[2]). Επειδή οι θέσεις σύνδεσης C/EBP υπάρχουν στις 5ʹ περιοχές υποκινητή των γονιδίων επαγόμενα από την IL‑17, η IL‑17 μπορεί επίσης να αυξήσει τη μεταγραφή ορισμένων στοχευμένων γονιδίων, όπως εκείνα που κωδικοποιούν την IL‑6 ή την λιποκαλίνη 2, παρά την ενεργοποίηση του C/EBPβ και του C/EBPδ [25]. Η σηματοδότηση μέσω του IL‑17RA μπορεί να ρυθμιστεί αρνητικά με την αποικοδόμηση της ACT1 υπό τη μεσολάβηση του συμπλόκου SCF (SKP1–CULLIN1–F-box)-τύπος Ε3 λιγάση της ουβικουϊτίνης [26] και του TRAF3 [27], που μπορεί να ανταγωνιστεί τη σηματοδότηση του NF-κB μέσω IL‑17RA εξαρτωμένου TRAF6. Η ACT1 προσδένεται στην περιοχή της C-Cʹθηλιάς (loop)[3] της κυτταροπλασματικής ουράς του IL‑17RA. Η συνθετική κατασκευή των μιμητών πεπτιδίων που ανταγωνίζονται αυτό τον δεσμό, μπορεί να αποκλείσει αποτελεσματικά την σηματοδότηση μέσω του IL‑17RA [28]. Ωστόσο, μένει να προσδιοριστεί κατά πόσον αυτές οι πρωτεΐνες ή γενικά αυτή η δυναμική προσέγγισης θα μπορούσαν να αντιπροσωπεύουν θεραπευτικούς στόχους για να αποκλειστεί ή να ενισχυθεί η σηματοδότηση IL‑17RA.
Τέλος, έχοντας υπόψη ότι η σηματοδότηση λαμβάνει χώρα με τον ολιγομερισμό των εξωκυτταρικών περιοχών του IL‑17RA και του IL‑17RC, θα μπορούσαν να αναπτυχθούν στρατηγικές που θα ανταγωνίζονται αυτή τη διαδικασία και θα μπλοκάρουν τον υποδοχέα σηματοδότησης [29].
ΒΙΒΛΙΟΓΡΑΦΙΑ
[1] Girolomoni G, Mrowietz U, Paul C. Psoriasis: rationale for targeting interleukin-17. Br J Dermatol. 2012 Oct;167(4):717-24. doi: 10.1111/j.1365-2133.2012.11099.x.
[2] Clinical Reviews in Allergy & Immunology February 2012, Role of IL-17 in Psoriasis and Psoriatic Arthritis, Siba P. Raychaudhuri.
[3] Aggarwal, S. & Gurney, A. L. IL‑17: prototype member of an emerging cytokine family. J. Leukoc. Biol. 71, 1–8 (2002).
[4] Yao, Z. et al. Human IL‑17: a novel cytokine derived from T cells. J. Immunol. 155, 5483–5486 (1995). This is the first paper to describe IL‑17.
[5] Fossiez, F. et al. T cell interleukin‑17 induces stromal cells to produce proinflammatory and hematopoietic cytokines. J. Exp. Med. 183, 2593–2603 (1996). This early study describes the role of IL‑17 in inflammation.
[6] Rouvier, E., Luciani, M. F., Mattei, M. G., Denizot, F. & Golstein, P. CTLA‑8, cloned from an activated T cell, bearing AU‑rich messenger RNA instability sequences, and homologous to a herpesvirus saimiri gene. J. Immunol. 150, 5445–5456 (1993)
[7] Hymowitz, S. G. et al. IL‑17s adopt a cystine knot fold: structure and activity of a novel cytokine, IL‑17F, and implications for receptor binding. EMBO J. 20, 5332–5341 (2001
[8] Wright, J. F. et al. Identification of an interleukin 17F/17A heterodimer in activated human CD4+ T cells. J. Biol. Chem. 282, 13447–13455 (2007).
[9] Zrioual, S. et al. Genome-wide comparison between IL‑17A- and IL‑17F‑induced effects in human rheumatoid arthritis synoviocytes. J. Immunol. 182, 3112–3120 (2009).
[10] Yang, X. O. et al. Regulation of inflammatory responses by IL‑17F. J. Exp. Med. 205, 1063–1075 (2008).
[11] Chang, S. H. et al. Interleukin‑17C promotes Th17 cell responses and autoimmune disease via interleukin‑17 receptor E. Immunity 35, 611–621 (2011).
[12] Wang, Y. H. et al. IL‑25 augments type 2 immune responses by enhancing the expansion and functions of TSLP‑DC‑activated Th2 memory cells. J. Exp. Med. 204, 1837–1847 (2007).
[13] Kleinschek, M. A. et al. IL‑25 regulates Th17 function in autoimmune inflammation. J. Exp. Med. 204, 161–170 (2007).
[14] Yao, Z. et al. Molecular characterization of the human interleukin (IL)-17 receptor. Cytokine 9, 794–800 (1997).
[15] Yao, Z. et al. Herpesvirus Saimiri encodes a new cytokine, IL‑17, which binds to a novel cytokine receptor. Immunity 3, 811–821 (1995).
[16] Toy, D. et al. Cutting edge: interleukin 17 signals through a heteromeric receptor complex. J. Immunol. 177, 36–39 (2006)
[17] Ely, L. K., Fischer, S. & Garcia, K. C. Structural basis of receptor sharing by interleukin 17 cytokines. Nature Immunol. 10, 1245–1251 (2009).
[18] Song, X. et al. IL‑17RE is the functional receptor for IL‑17C and mediates mucosal immunity to infection with intestinal pathogens. Nature Immunol. 12, 1151–1158 (2011).
[19] Ramirez-Carrozzi, V. et al. IL‑17C regulates the innate immune function of epithelial cells in an autocrine manner. Nature Immunol. 12, 1159–1166 (2011).
[20] Chang, S. H., Park, H. & Dong, C. Act1 adaptor protein is an immediate and essential signaling component of interleukin‑17 receptor. J. Biol. Chem. 281, 35603–35607 (2006).
[21] Qian, Y. et al. The adaptor Act1 is required for interleukin 17‑dependent signaling associated with autoimmune and inflammatory disease. Nature Immunol. 8, 247–256 (2007).
[22] Hot, A. & Miossec, P. Effects of interleukin (IL)-17A and IL‑17F in human rheumatoid arthritis synoviocytes. Ann. Rheum. Dis. 70, 727–732 (2011).
[23] Henness, S. et al. IL‑17A augments TNF-α-induced IL‑6 expression in airway smooth muscle by enhancing mRNA stability. J. Allergy Clin. Immunol. 114, 958–964 (2004)
[24] Hartupee, J., Liu, C., Novotny, M., Li, X. & Hamilton, T. IL‑17 enhances chemokine gene expression through mRNA stabilization. J. Immunol. 179, 4135–4141 (2007)
[25] Shen, F., Hu, Z., Goswami, J. & Gaffen, S. L. Identification of common transcriptional regulatory elements in interleukin‑17 target genes. J. Biol. Chem. 281, 24138–24148 (2006).
[26] Shi, P. et al. Persistent stimulation with interleukin‑17 desensitizes cells through SCFβ-TrCP-mediated degradation of Act1. Sci. Signal. 4, ra73 (2011).
[27] Zhu, S. et al. Modulation of experimental autoimmune encephalomyelitis through TRAF3‑mediated suppression of interleukin 17 receptor signaling. J. Exp. Med. 207, 2647–2662 (2010).
[28] Liu, C. et al. A CCʹ loop decoy peptide blocks the interaction between Act1 and IL‑17RA to attenuate IL‑17- and IL‑25‑induced inflammation. Sci. Signal. 4, ra72 (2011).
[29] Kramer, J. M. et al. Evidence for ligand-independent multimerization of the IL‑17 receptor. J. Immunol. 176, 711–715 (2006).
[30] Rong, Z. et al. IL‑17RD (Sef or IL‑17RLM) interacts with IL‑17 receptor and mediates IL‑17 signaling. Cell Res. 19, 208–215 (2009).
[1] Πτυχωτά μοτίβα κυστίνης
Μοτίβα που περιγράφηκαν για πρώτη φορά στον αυξητικό παράγοντα των νεύρων (NGF), όπου δύο δισουλφιδικές γέφυρες σχηματίζονται από ζεύγη μορίων κυστεΐνης. Αυτό το μοτίβο συμβάλλει στη σταθερότητα πρωτεΐνης.
[2] CCAAT/ενισχυτής – πρωτεΐνες δέσμευσης (C/EBPs
Μια οικογένεια παραγόντων μεταγραφής που ρυθμίζουν τη γονιδιακή έκφραση αλληλεπιδρώντας με το μοτίβο της περιοχής CCAAT
[3] C-Cʹθηλιά (loop)
Μία περιοχή της κυτταροπλασματικής περιοχής SEFIR (εκ του SEF και της ομόλογης περιοχής TIR (Toll/IL-1R)) του υποδοχέα της ιντερλευκίνης-17 (IL-17), που ορίζεται από τον τρίτο κλώνο (C) και την τρίτη έλικα (Cʹ).